云舟生物提供用于RNA和质粒基因递送的脂质纳米颗粒(LNP)封装服务。我们制备的高均一度LNP可达到很高的封装效率。此外,我们还可以通过制备抗体偶联的LNP或优化LNP配方来提高LNP的基因递送效率和靶向性。如果您需要规模化生产LNP-RNA药物,请查看我们的CDMO服务。
亮点
- 标准配方(SM102、ALC-0315、MC3)或自定义配方
- 从载体克隆到LNP封装快至5周
- 可封装多种类型的RNA/DNA分子,包括mRNA、saRNA、Cas9 mRNA/sgRNA混合物、circRNA、pDNA等
- 高封装效率(可达100%)
- 多分散指数低(PDI <0.1)
- 可制备抗体偶联的LNP
质量控制
云舟生物提供多种QC方法检测RNA和质粒的LNP封装质量。
| 性质 | QC试验 | 科研级 | GMP-like |
| 外观 | 目视检测 | √ | √ |
| 浓度 | RiboGreen试验 | √ | √ |
| 封装效率 | RiboGreen试验 | √ | √ |
| 粒径 | 动态光散射(Zetasizer) | √ | √ |
| 多分散指数(PDI) | 动态光散射(Zetasizer) | √ | √ |
| 表明电荷(Zeta电势) | 动态光散射(Zetasizer) | √ | √ |
| 封装的RNA完整性 | 毛细管电泳(CGE) | 可选 | √ |
| 内毒素 | 动态显色法(KCA) | 可选 | √ |
| pH | pH试纸 | 可选 | √ |
| 无菌性 | 生物负荷测试 | 可选 | √ |
LNP-mRNA数据
- TEM
- PDI和Zeta电势
- LNP冻存测试
冷冻透射电子显微镜(cryo-TEM)结果显示我们封装的LNP-mRNA结构完整且大小均一。
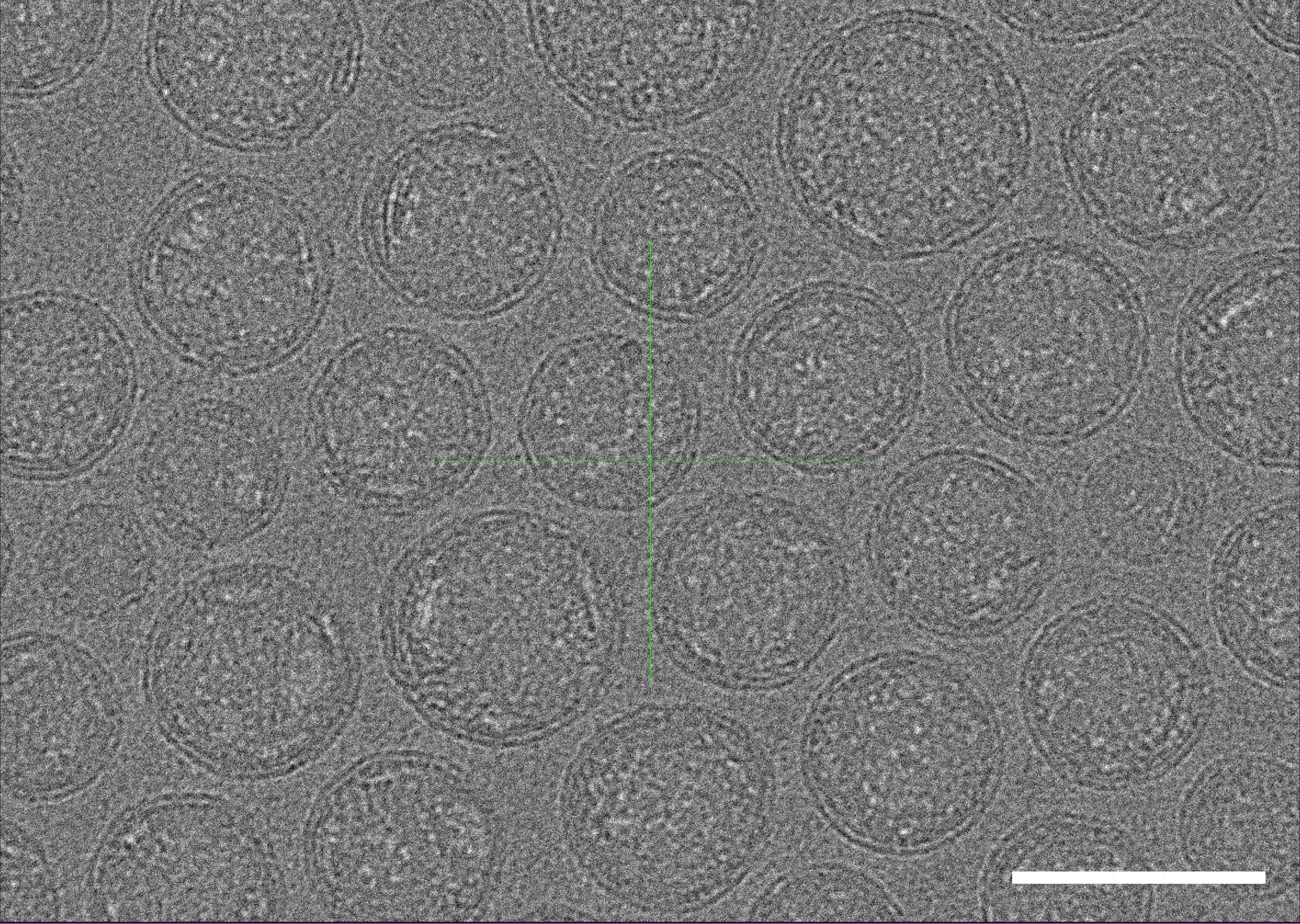
图1 冷冻透射电子显微镜(cryo-TEM)视野下的LNP-mRNA。LNP保存于-80℃含有蔗糖的Tris溶液(pH7.4),冰上解冻后拍摄。比例尺=100 nm。
动态光散射(DLS)分析表明我们的LNP-mRNA可以达到很低的PDI值(PDI<0.1)。云舟生物承诺我们的LNP-mRNA的Zeta电势范围在-10 mV至+10 mV之间。
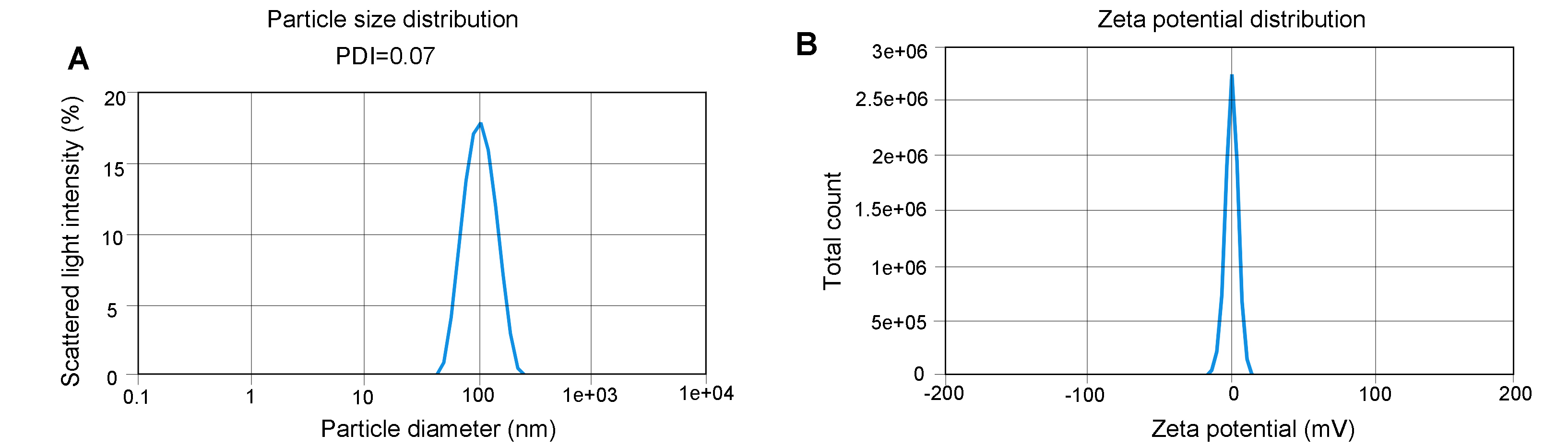
图2 LNP粒径和Zeta电势分析多分散指数(PDI)。(A)和Zeta电势(B)通过动态光散射(DLS)测定。该方法可以测量粒子运动带来的散射光强度的波动变化。反映的则是样本中的粒子尺寸的异质性。样本中的Zeta电势范围在-1.872到+1.872 mV之间。

图3. 对偶联有anti-CD31的LNP-mRNA进行长期冷冻保存(153天)测试。(A)使用两种条件测试表达萤火虫荧光素酶的LNP-mRNA的保存效果:4℃、无添加剂;-80℃、7.5%蔗糖溶液。两组样品均测试了冷冻保存后的粒径(粉色柱子)和PDI(深蓝色点),并与其冷冻前的参数进行对比。(B)注射Fluc mRNA 6小时后的荧光图像。将以上两组经过冷冻保存的LNP-mRNA分别与PBS一同静脉注射雌性ICR小鼠。(C)经过冷冻保存后的LNP-mRNA封装效率。使用新鲜制备的 FLuc LNP-mRNA作为对照。(D)冷冻保存后,比较RNA的完整性。总体而言,我们的数据表明,抗体偶联的LNP-mRNA在-80℃、7.5%蔗糖溶液中经过长期冷冻保存,可以有效保持其颗粒均一性、封装效率,以及mRNA表达效果。
LNP-RNA功能验证
- CAR-T细胞毒性杀伤
- 人类 T 细胞的 LNP 转染
- LNP-mRNA体内表达
- LNP-mRNA体外表达

图4 使用VectorBuilder的LNP-mRNA体系制备人源CAR-T细胞,实验结果显示出其对CD19⁺细胞具有细胞毒性。(A)使用脂质纳米颗粒(LNP)将抗CD19CAR的mRNA封装,再将其转染进原代人T细胞,随后把这些CAR-T细胞与CD19⁺Raji细胞共孵育,通过检测释放的乳酸脱氢酶(LDH)来验证其杀伤功能。(B)分别编码带有不同共刺激结构域4-1BB(CD19-BBz,1949nt)或CD28(CD19-28z,1931nt)的抗CD19CAR的IVTmRNA被包封进LNP。(C)活化的人T细胞用对应的LNP-mRNA转染后,检测其表面CD19CAR的表达以验证转染效果。(D)将CAR-T细胞与Raji细胞以不同效靶(E:T)比例共孵育18小时后,通过LDH测定法检测T细胞诱导的细胞毒性。

图5 使用 EGFP LNP-mRNA 实现高效的人类 T 细胞转染。(A) 活化的 T 细胞用 (C)LNP封装的(B)EGFP mRNA转染 ,剂量为每 1×10⁶个细胞 6 μg mRNA。(D)转染后 24 小时,使用荧光显微镜和流式细胞术对 EGFP 的表达进行成像和分析。
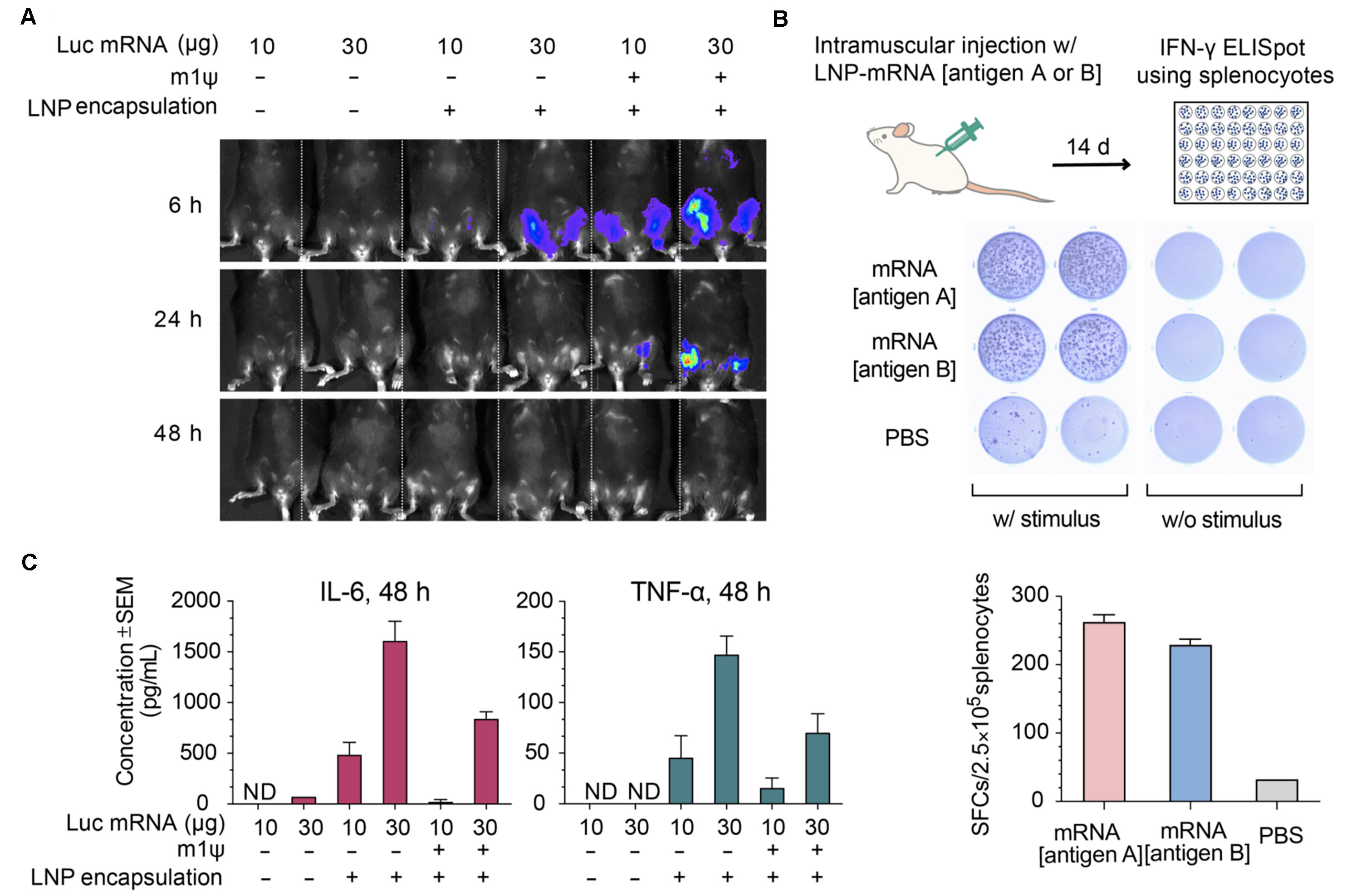
图6 鼠转导萤光素酶mRNA(Luc mRNA),检测mRNA表达情况和免疫反应。(A)注射后6 h、24h、和48 h通过活体成像检测萤光素酶活性。 (B)为量化外源RNA在小鼠中引发的炎症反应,注射后48小时检测小鼠血清中两种促炎细胞因子IL-6和TNF-α的浓度。 误差线表示标准偏差。小鼠种系:C57BL/6J;小鼠年龄:8周;注射方法:肌肉注射。(C)向Balb/C小鼠注射30 ug的LNP封装的mRNA,注射后14天,分离Balb/C小鼠的脾脏细胞,针对病毒抗原A、病毒抗原B以及PBS对照进行IFN-γ ELISpot试验。
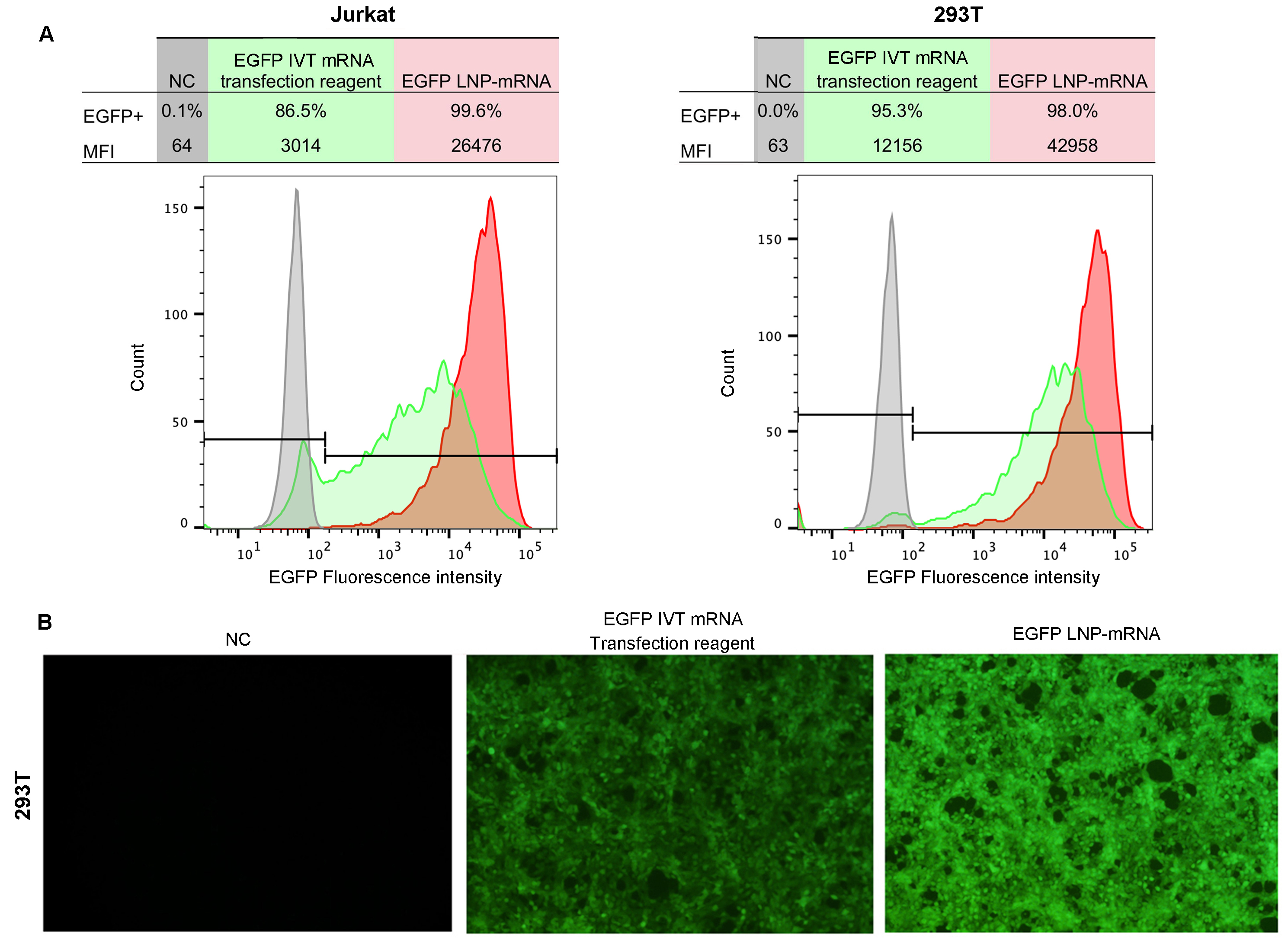
图7 使用LNP高效递送mRNA。对比使用传统转染试剂,LNP封装的EGFP mRNA表现出更高递送效率。向Jurkat和293T细胞转染1 ug的EGFP mRNA:(A)流式细胞术分析EGFP表达水平。(B)转染后24 h拍摄细胞荧光图片。实验中使用的EGFP mRNA均无核苷修饰。 荧光强度中值表示为MFI。
LNP优化
- 抗体偶联的LNP
- 配方优化
- 新型配方
- 靶向特定组织的LNP
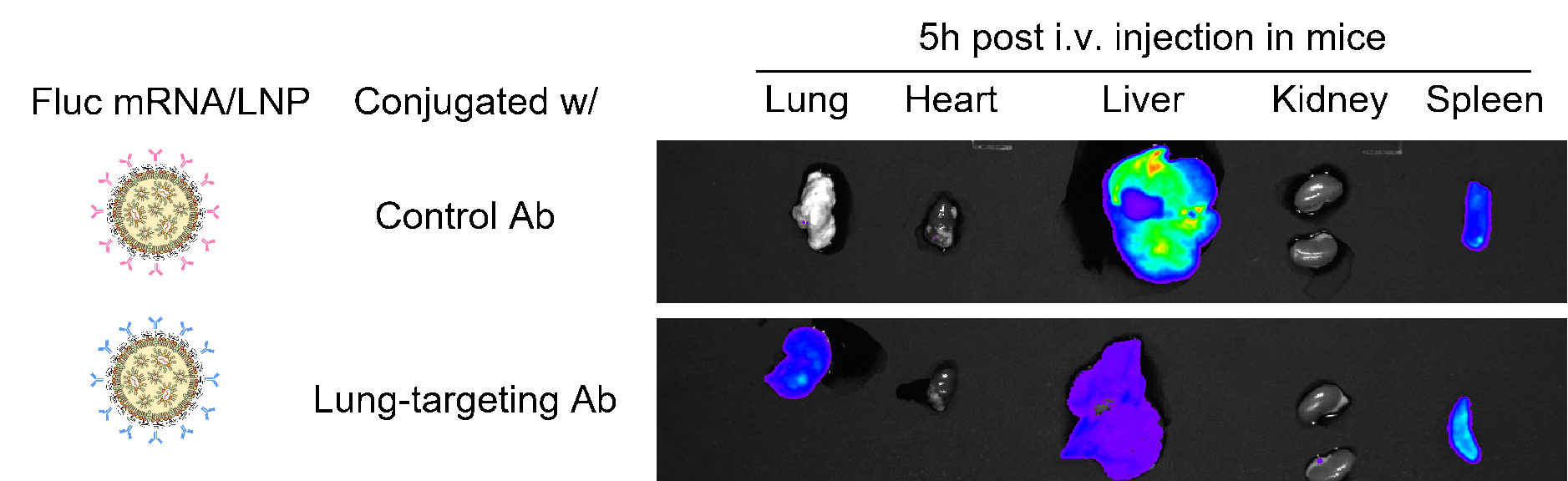
图8 表达萤火虫荧光素酶(FLuc)的LNP-mRNA在偶联anti-CD31抗体后在肺部的表达效率提升。小鼠品系:C57BC/6J ;小鼠年龄:6-8周;小鼠性别:雌性;注射途径:尾静脉注射;对照:IgG2a偶联的Fluc-mRNA。
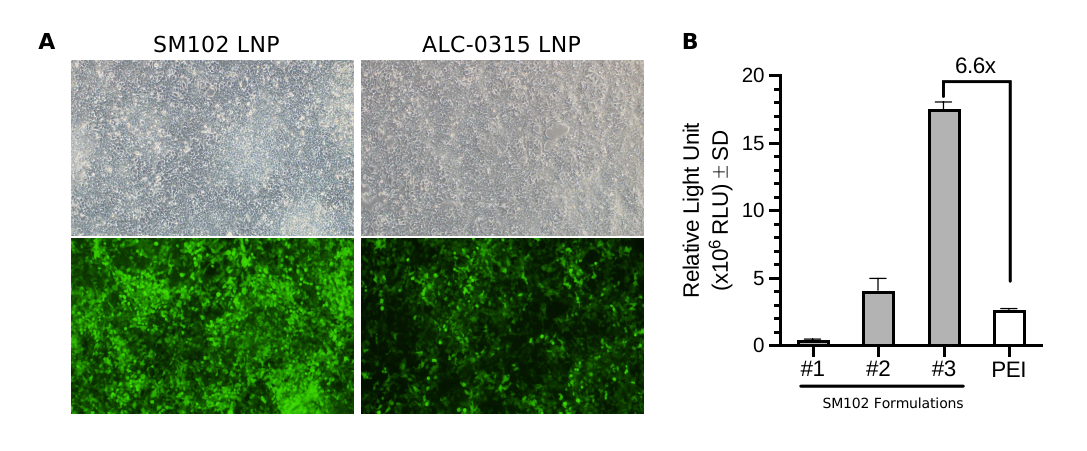
图9 LNP配方优化可提高质粒体外转染效率。(A)表达EGFP的质粒(pDNA-CMV>EGFP)分别采用SM102和ALC-0315两种LNP封装,转染HEK293T细胞。转染后24 h拍摄EGFP荧光图像。(B)基于SM102优化的配方可以获得相较于商业化PEI转染试剂高约6.6倍的转染效率。该实验中的质粒(pDNA-CMV>Fluc)表达萤火虫荧光素酶报告基因。
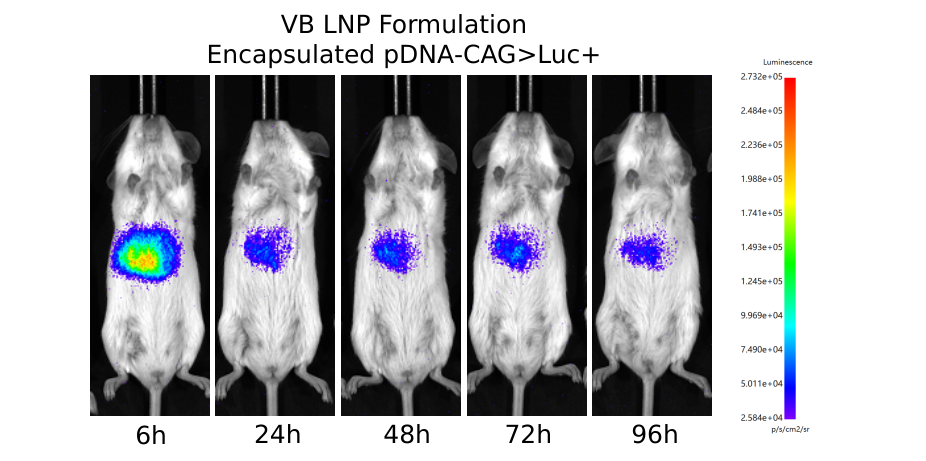
图10 采用云舟生物新型LNP配方封装萤火虫荧光素酶报告基因表达质粒(pDNA-CAG>Luc+),按照0.6 mg每千克体重静脉注射小鼠。注射后96 h观察萤火虫荧光素酶报告基因表达情况。

图11 使用抗体偶联的纳米脂质颗粒(LNP)实现组织特异性的mRNA递送。(A)向两组携带有Cre依赖的tdTomato表达盒的Ai9小鼠各自静脉注射特定类型的LNP封装的Cre mRNA(0.4 mg/kg)。其中一种LNP经过anti-CD31抗体偶联,另一种则无抗体偶联。(B)注射后72 h,观察肺部tdTomato表达效果。
文档
使用说明书
IVT mRNA的体外应⽤
LNP-mRNA的体内应用
手册与宣传单
RNA:从设计到疗法
mRNA基因递送解决方案
EGFP与HiExpress萤火虫荧光素酶IVT mRNA
MSDS
RNA
LNP-mRNA
品质检验证书(COA)
检索COA